 Os problemas com sono agravados pela pandemia têm uma forte influência do estresse e da rotina, como o horário em que a pessoa vai dormir, a quantidade de horas dormidas e outros fatores que atrapalham uma boa noite de sono e podem passar despercebidos de imediato, mas tornam o dia seguinte exaustivo.
Os problemas com sono agravados pela pandemia têm uma forte influência do estresse e da rotina, como o horário em que a pessoa vai dormir, a quantidade de horas dormidas e outros fatores que atrapalham uma boa noite de sono e podem passar despercebidos de imediato, mas tornam o dia seguinte exaustivo.
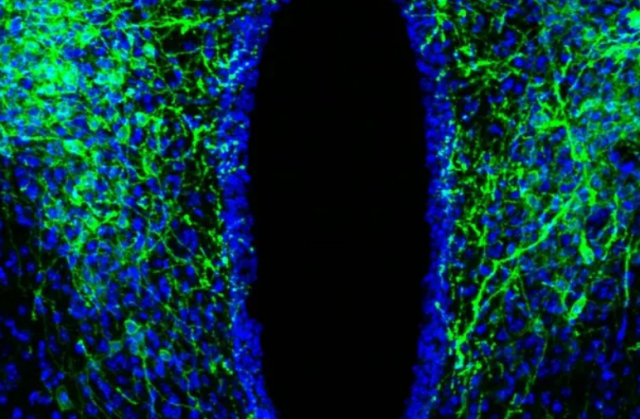
Um estudo conduzido pela Universidade de Nagoya, no Japão, por meio de uma pesquisa feita em camundongos e hipopótamos conseguiu identificar uma via neural que liga relógio biológico, estresse e estado de vigília dos animais.
Os pesquisadores identificaram um neurônio chamado de 'neurônio do fator liberador de corticotropina' (CRF), que se torna excessivamente ativo quando o animal está sob estresse, o que pode desencadear insônia e outros distúrbios do sono.
A hiperatividade dos neurônios CRF devido ao estresse ou distúrbio do ritmo circadiano podem causar insônia e outros distúrbios do sono em humanos. Para os humanos, as descobertas podem levar ao desenvolvimento de novas terapias para distúrbios do sono.
Estresse demais e sono de menos
O estresse manifestado nos animais do levantamento como causador de distúrbios no sono parece se assemelhar com problemas manifestados por humanos.
A estudante Júlia Nogueira da Silva, 23 anos, normalmente dorme cerca de 4 horas por dia devido ao trabalho e à rotina acadêmica. As poucas horas de sono são o suficiente para proporcionar um desgaste e cansaço diário. "Isso bagunçou completamente minha rotina, me sinto indisposta, desanimada e extremamente cansada", conta.
Segundo Júlia, o estresse atrapalha na hora de ir dormir e após acordar: "Demoro para dormir justamente por me sentir ansiosa, e consequentemente, já acordo estressada e fico assim o dia todo".
Já a analista Ramires Gomes, de 24 anos, apesar de dormir horas suficientes para ficar disposta durante o dia, a rotina afetada pela pandemia gera um estresse e acaba atrapalhando o seu horário de pegar no sono. "Às vezes, quando estou estressada por qualquer motivo, isso fica na minha cabeça na hora de ir para a cama, esse pensamento fica rondando e eu acabo demorando muito para pegar no sono".
Resultados da pesquisa
Segundo os pesquisadores, em mamíferos, o relógio circadiano central (relógio biológico), localizado nos neurônios do chamado núcleo supraquiasmático (centro primário de regulação dos ritmos circadianos) do cérebro, regula o ciclo vigília-sono.
No entanto, em situações de risco de vida, o sinal do ritmo circadiano é desligado para manter o animal acordado para que ele possa escapar do perigo mesmo quando normalmente seria hora de dormir. Embora o desligamento temporário do ciclo vigília-sono seja necessário para a sobrevivência, o estresse excessivo ou prolongado causado por esses perigos pode desencadear insônia e outros distúrbios do sono.
Os pesquisadores analisaram neurônios CRF conhecidos por desempenhar um papel na resposta ao estresse. Eles investigaram como o sono e a vigília (despertar) em camundongos seriam afetados quando os neurônios CRF estivessem ativados.
Os resultados apontaram que os neurônios ativados mantinham os animais acordados, fazendo com que eles se movessem de forma mais vigorosa, indicando o estado de vigília. Os pesquisadores também observaram que os neurônios CRF permaneceram ativos quando os ratos estavam acordados e que, quando a atividade dos neurônios foi anulada, a vigília e as atividades locomotoras dos animais foram reduzidas.
Como identificar problemas no sono?
É possível identificar possíveis problemas com o sono por meio de três pontos:
dificuldades em iniciar o sono
fragmentação do sono durante a noite
dificuldades de voltar a dormir durante a noite
Se esses fatores levam a consequências no dia a dia, esse indivíduo está sofrendo com insônia. Nesse caso é importante procurar um especialista para indicar o tratamento adequado.
A quantidade de horas dormidas que podem ser consideradas saudáveis variam de acordo com o relógio biológico de cada pessoa.
Segundo os especialistas, a primeira medida que deve ser tomada para ter uma boa noite de sono é entender o seu próprio relógio biológico e descobrir quantas horas de sono são necessárias para te deixar disposto. A partir disso, o indivíduo deve se disciplinar para mudar a rotina.
G1
Foto: Divulgação/ Daisuke Ono
















 Para imunizar toda a população acima de 18 anos contra a covid-19, o Brasil teria que ter à disposição pelo menos 161 milhões de doses de um imunizante que fosse em aplicação única.
Para imunizar toda a população acima de 18 anos contra a covid-19, o Brasil teria que ter à disposição pelo menos 161 milhões de doses de um imunizante que fosse em aplicação única.